AB - berri.es
Transcript of AB - berri.es

CAPÍTULO 24 • Chlamydia, Rickettsia y organismos similares 535
sideran a los EIA como pruebas por debajo del estándar para la detección de C. trachomatis y no se recomiendan para el diagnóstico. Hibridación de ácidos nucleicos y ensayos de amplificación. Debido a la elevada sensibilidad y especificidad, las NAAT son el mé-todo preferido para el diagnóstico de la infección con C. trachomatis. Las NAAT detectan 20 a 50% más infecciones por C. trachomatis que el cultivo o los ensayos sin cultivo iniciales. Las NAAT ofrecen varias ventajas, que incluyen la aprobación de la Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en inglés) para detectar C. trachomatis en los hisopados endocervicales de muje-res, los hisopados uretrales de hombres y la orina tanto de mujeres como de hombres. Estos ensayos pueden tener la ventaja añadida de detectar dos STD en una muestra: gonorrea e infección por C. trachomatis. La sensibilidad, especificidad, PPV y valor predictivo negativo son mayo-res que los reportados para el EIA y los cultivos. Los resultados pueden obtenerse con rapidez y la evaluación es menos demandante desde el punto de vista técnico en comparación con el cultivo. A pesar de ello, hasta ahora ninguna NAAT ha sido aprobada para uso en muestras conjuntivales, orofaríngeas o rectales. Los ensayos tampoco pueden distinguir las cepas LGV de otras cepas de C. trachomatis. Las NAAT utilizan diferentes métodos para amplificar y detectar las secuencias de ADN o ARN específicas de los organismos. Cinco ensa-yos están autorizados hoy en día para uso en Estados Unidos para la detección de C. trachomatis en muestras clínicas: el Amplicor y Cobas CT/NG basados en PCR (Roche Molecular Systems, Indianápolis, IN), el Abbott RealTime m2000 (Abbott Molecular, Des Plaines, IL), el ensayo de amplificación APTIMA mediado por transcripción (Hologic,
de una copa, se ha encontrado que la técnica de shell vials (véase el Capítulo 29) es más sensible que el método de micropozos. La muestra se centrifuga sobre la monocapa celular y se incuba por 48 a 72 horas. Se pueden usar anticuerpos monoclonales marcados con fluoresceí-na para detectar las inclusiones clamidiales. Existen varios anticuerpos fluorescentes disponibles a nivel comercial. Algunos laboratorios uti-lizan anticuerpos monoclonales específicos de especie que se unen a la MOMP, mientras que otros prefieren al anticuerpo específico de fami-lia, que se une a un componente LPS. Se reporta que los anticuerpos monoclonales contra la MOMP ofrecen la fluorescencia más brillante, con una morfología bacteriana consistente y una coloración menos inespecífica que los anticuerpos monoclonales contra el LPS. Se puede usar yodo o coloración de Giemsa, aunque estos métodos son menos sensibles o específicos y ya no se recomiendan (Fig. 24.7). Inmunoensayos. El inmunoensayo enzimático (EIA, por sus siglas en inglés) utiliza un anticuerpo monoclonal y policlonal dirigido contra el LPS de la clamidia. Se dispone de varios kits comerciales y todos tienen ventajas similares. Estas incluyen la capacidad para el tamizaje de gran-des números de muestras, la obtención de resultados objetivos, la dispo-nibilidad de resultados de la prueba en 3 a 5 horas, así como el uso de diversos tipos de muestras. No obstante, ninguno de ellos iguala la sen-sibilidad del cultivo y la mayoría es significativamente menos sensible. Además, un resultado positivo debe considerarse como preliminar y debe verificarse debido a que los métodos de detección de antígenos pueden dar un resultado falso positivo cuando se utilizan en poblaciones de baja prevalencia (< 5%). No se deben utilizar EIA en muestras de orina o de hisopado vaginal. Debido a estas limitaciones, los CDC con-
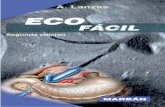
A B
FIG. 24.6. A, B, Examen citológico de muestras endocervicales que demuestra cuerpos de inclusión consistentes con Chlamydia trachomatis (tinción de Papanicolau; A, 600X; B, 600X).
A B
FIG. 24.7. Cuerpos de inclusión de células de McCoy infectadas con Chlamydia trachomatis teñidos con yodo. Nótese el tamaño y la forma en media luna de la inclusión (A, 400X; B, 1000X).