10 Activación linfocitos T
-
Upload
paola-alexandra-vazquez-martinez -
Category
Documents
-
view
219 -
download
16
Transcript of 10 Activación linfocitos T

10 Activación linfocitos T
(Ver capitulo actualizado en www.inmunologiaenlinea.es) E. Muñoz y J. Peña
Interacción celular Transmisión señales CD45 PKC PLC Otras cinasas Factores transcripción
INTRODUCIÓNLa activación de los linfocitos T se produce tras el reconocimiento por parte del TCR/CD3 de la molécula HLA y el péptido presentado por la misma junto con otros procesos, como son la activación de ciertas moléculas accesorias presentes en su membrana. También en este proceso de activación se hace mas eficiente si los linfocitos reciben el estimulo de ciertas citocinas mediante su unión a los receptores específicos presentes también en la membrana de estos linfocitos. Una vez activados los linfocitos T, estos prioritariamente producirán citocinas o factores citotóxicos, según se trate de linfocitos T CD4+ o CD8+. De esta manera se desarrollará la respuesta inmune. Los linfocitos T CD4+
colaborarán en la posterior activación de otras células, tales como NK, T CD8+, linfocitos B o macrófagos. A su vez los linfocitos T CD8+ tras su activación ejercerán su función citotóxica destruyendo células blanco (Figura 10.1) .Fenómenos de interacción celular. El proceso de reconocimiento varía si el receptor de la célula T está formado por el heterodímero alfa/beta (células T alfa/beta CD4+ o CD8+) o si es del tipo gamma/delta (células T gamma/delta CD4-/CD8-), ya que en estas últimas no existe función coestimuladora por parte de las moléculas accesorias CD4 y CD8 (no se puede producir la unión MHC-CD4 o MHC-CD8). Como se dijo anteriormente, las moléculas de histocompatibilidad "no clásicas" pueden presentar péptidos antigénicos a los receptores gamma/delta.En muchos casos la unión del antígeno con el TCR no es suficiente para dar lugar a una respuesta inmune eficaz. Para que esta respuesta se lleve a cabo se requiere la participación de una serie de moléculas conocidas globalmente como accesorias, y cuya función es precisamente la de contribuir al desarrollo de una respuesta

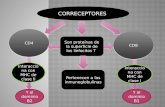
inmune efectiva facilitando la interacción entre las distintas células. Se forma así lo que se viene en denominar sinapsis entre linfocitos T y célula presentadora de antígeno (Figura 10.2). Las principales moléculas que están implicadas en este fenómeno de reconocimiento son el CD4, CD8, CD2, CD45 y CD28 y sus ligandos respectivos. Todas estas moléculas de adhesión también juegan un importante papel en la transducción de señales y activación de la célula T. En la Figura 10.3 se recoge un esquema de las distintas posibilidades de activación de los linfocitos T según las moléculas que intervienen en los procesos de reconocimiento y adhesión intercelular.Moléculas CD4 y CD8.Las moléculas CD4 y CD8 son glicoproteínas cuyos ligandos naturales son las moléculas del MHC de clase II y de clase I respectivamente. La molécula CD4 pertenece a la superfamilia de las inmunoglobulinas y esta formada por una sola cadena. La molécula CD8 pertenece también a la superfamilia de las Igs, pero su estructura difiere considerablemente de la anterior, al estar formada por dos cadenas homólogas, alfa y beta, que pueden formar heterodímeros o, en menor proporción, homodímeros (alfa/alfa).Las interacciones de estas moléculas con el HLA, juegan un papel esencial en la maduración tímica de los linfocitos. De hecho, el fenotipo CD4/CD8 de un determinado linfocito T determina su función efectora. Así, mientras el CD4 se expresa en la mayoría de los linfocitos T cooperadores, la molécula CD8 se presenta, principalmente, en aquellos linfocitos T con función citotóxica. Es lógico que las células T con fenotipo CD8+ reconozcan antígenos en el contexto de moléculas MHC de clase I, ya que éstas tienen una distribución tisular universal, pudiéndose realizar así la función citotóxica, reconocimiento y lisis, de cualquier célula del organismo que se encuentre infectada por virus.Moléculas CD2Las moléculas CD2 junto con el CD11a/CD18 (LFA-1) son las moléculas de adhesión primaria que contribuyen a potenciar la afinidad de unión del linfocito T a la célula presentadora. Sus ligandos naturales que son el CD58 (LFA-3) y CD54 (ICAM-1) respectivamente, se expresan en la superficie de todas las células que realizan la función de APC. El CD2 es una glicoproteína presente en la superficie de timocitos y linfocitos T, organizada en dos dominios globulares extracitoplasmáticos, una región transmembrana y una larga región intracitoplasmática. Esta molécula es la primera molécula que se expresa en el linaje T durante su diferenciación y se encuentra en todos los timocitos y células T maduras. Además de su papel en la interacción entre células, está implicado en una vía alternativa de activación T antígeno-independiente. Otras moléculas de membrana que intervienen en el proceso de adhesión son

CD5 y CD40, cuyos ligandos en la APC son, respectivamente, CD72 y CD40L.Moléculas CD28
Las moléculas CD28 son también de especial importancia en los mecanismos de adhesión celular. El CD28 se expresa en todos los linfocitos CD4 y aproximadamente en el 50% de los linfocitos CD8, sus ligandos naturales pertenecen a la familia B7 (B7-1, CD80; B7-2, CD86). CD28, además de su papel en el proceso de adhesión, también participa en el mecanismo de transducción de señal y activación de la célula T ya que el CD28 induce la denominada segunda señal de activación celular (la primera está generada por el TCR/CD3). En ausencia de esta segunda señal, los linfocitos T pueden anergizarse por la primera señal de activación dependiente TCR/CD3. Esta segunda señal parece ser regulada negativamente por la molécula CTLA-4 (Cytotoxic T Lymphocyte Antigen 4). Solo un número muy pequeño de moléculas MHC con el péptido apropiado están presente en un área dada del contacto célula-célula establecido con el proceso de adhesión. Gracias a la habilidad del TCR/CD3 de formar estructuras ordenadas, los complejos MHC con el péptido correcto migran dentro de la interfase. Esto provoca una alta densidad local de complejos TCR/CD3 cooperando en la unión antigénica. Transmision de señales Todas las células eucariotas incluidos los linfocitos T, B y NK poseen mecanismos a través de los cuales los estímulos externos son procesados y enviados al núcleo a través de una serie de cambios bioquímicos que conocemos genéricamente como señales de activación intracelulares o de transducción de señales. Estos mecanismos implican la formación de los denominados segundos mensajeros que son capaces de regular la transcripción específica de un amplio número de genes, los cuales participan en los procesos de crecimiento, división y diferenciación celular. En la activación de esta cadena de segundos mensajeros intervienen señales procedentes tanto del TCR/CD3 como de las moléculas accesorias y receptores de citocinas presentes en la membrana de los linfocitos (Figura 10.4). Un mecanismo fundamental en la regulación de la actividad y la función de numerosas proteínas en las células eucarióticas son los ciclos de fosforilación y defosforilación mediados por cinasas y fosfatasas. Básicamente existen dos tipos de cinasas, dependiendo de su actividad fosfotransferasa la cual se manifiesta fosforilando proteínas en aminoácidos serina y treonina (serina/treonina cinasas) o bien en aminoácidos tirosina (tirosina cinasas). Igualmente hay fosfatasas que defosforilan específicamente proteínas fosforiladas bien en serina/treonina o en tirosina.Una propiedad general de los linfocitos es la necesidad de generar dos señales distintas para inducir la

proliferación hacia células efectoras. Como se ha comentado anteriormente la primera señal la proporciona la unión del complejo péptido-MHC al TCR (y a los co-receptores CD4 y CD8), esta señal está potenciada por moléculas de adhesión (CD2, el LFA-1, el CD26, etc.). La segunda señal es suministrada por moléculas co-estimuladoras del tipo CD28, que de alguna manera complementan las señales de activación inducidas por el TCR permitiendo una activación celular completa (Figura 10.5) . Estas señales coestimuladoras son necesarias para la activación del linfocito, ya que en su ausencia la señal mediada por el TCR puede conducir al linfocito a la muerte celular o a un estado de anergia (en la que el linfocito no responde a nuevas estimulaciones).Después de la ocupación de los receptores T por el antígeno, se produce la activación de los linfocitos y la iniciación de eventos tempranos de traducción de señales que finalmente conducen a la reprogramación génica y a la adquisición de funciones efectoras. Para que el linfocito T pueda llevar a cabo estas funciones se requiere un complejo sistema responsable de la transmisión de señales de activación desde la superficie al interior de la célula. En esta última década se está realizando un gran esfuerzo para identificar los componentes celulares y moleculares que están involucrados en dicha activación celular y determinar la secuencia de eventos bioquímicos que ocurren después del reconocimiento del antígeno.ESTÍMULOS INICIADOS POR EL TCR.Uno de los primeros eventos bioquímicos que ocurren en linfocitos T después de la interacción Ag-TCR, es el incremento de fosforilación en tirosina de las cadenas no polimórficas del CD3. Estas cadenas poseen en sus dominios intracitoplasmáticos unas regiones denominadas ITAM (Immunoreceptor Tyrosine-based Activation Motifs) que se fosforilan por la acción de las tirosina cinasas c-lck o c-fyn.La tirosina cinasa c-lck se encuentra localizada en la parte intracelular de la membrana plasmática unida a la bicapa lipídica por un proceso de miristilación de su región aminoterminal (Figura 10.6). La asociación física y funcional del CD4 y del CD8 con el TCR/CD3, hace que la c- lck asociada a estas moléculas se aproxime a la porción citoplásmica de las proteínas del complejo CD3, donde puede fosforilar en tirosina a sus regiones ITAM. Además del CD3 esta cinasa puede también fosforilar otros substratos como es el caso de PLC-gamma-1 (fosfolipasa C-gamma-1) que participa en la regulación del sistema inositol fosfato que se describirá más adelante. C-fyn, al igual que c-lck es otra tirosina cinasa que pertenece a la familia de cinasas Src. También está anclada a la cara interna de la membrana celular por miristilación de su porción aminoterminal. Esta cinasa está físicamente asociada al TCR y su actividad está regulada por la ocupación y activación del mismo.

Una vez que los ITAM son fosforilados en residuos tirosinas, se convierten en sitios específicos de acoplamiento que se unen a proteínas citoplásmicas con dominios SH2. La función de los dominios SH2 es interactuar con algunas proteínas que se encuentran fosforiladas en residuos tirosina, así su función esta regulada por procesos fosforilación-desfosforilación de estos aminoácidos. Por este motivo, un dominio SH2 puede interactuar con una fosfotirosina adyacente en la misma o en otra molécula. Cuando es sobre la misma molécula contribuye al control de su propia actividad enzimática. En otras ocasiones, la enzima con el dominio SH2 interacciona a través de dicho motivo con otras proteínas previamente fosforiladas en tirosina por otra cinasa. Esta interacción es responsable de su activación y de la de otros substratos. Este es el caso de la enzima ZAP-70 que se activa cuando a través de sus dominios SH2 se une a las cadenas que han sido previamente fosforiladas por c- fyn o c-lck. ZAP-70 desempeña un papel crítico en el mantenimiento de la cascada de señales que se pone en marcha tras el reconocimiento del antígeno por el TCR. En este sentido, esta enzima es un acoplador de señales desde la superficie celular al núcleo por fosforilación de los adaptadores Lat y SLP-76. Lat es una proteína transmembrana cuya función, una vez fosforilada, es organizar complejos multimoleculares en determinados subdominios lipídicos de la membrana plasmática. Estos complejos contienen proteínas claves en la señalización al interior de la célula como son la PLC-gamma1 (fosfolipasa C), el Grb-2 (growth factor binding protein), SLP-76, la PI3K y Vav-1 FOSFATASA CD45 El CD45, LCA (Antígeno común leucocitario) o T200 es una de las glicoproteínas más abundantemente expresadas en la superficie de células hematopoyéticas, pudiéndose detectar hasta un millón de moléculas por célula El CD45 presenta una larga región citoplasmática que contiene dos dominios catalíticos con actividad fosfatasa, una región intra-membrana y una región aminoterminal extracelular que se encuentra glicosilada y que varía en su estructura. Esta variedad ha sido explicada después del clonaje e identificación del gen que, codificada dicha proteína, el cual gracias a que puede transcribir de forma alternativa los tres exones (A, B y C) que codifican la porción aminoterminal de la proteína. Esta transcripción alternativa puede generar hasta ocho diferentes ARN mensajeros que traducen al menos seis diferentes isoformas del CD45 en la membrana celular (Figura 10.7). El ligando del CD45 no se conoce y la existencia de estas diferentes isoformas pueden indicar que los ligandos del CD45 sean múltiples y medien diferentes funciones en diferentes subpoblaciones de linfocitos T.Diferentes sistemas experimentales han demostrado que el CD45 juega un papel predominante en los procesos de activación celular mediados por la ocupación del TCR. Aunque teórica, la función que más frecuentemente se atribuye

al CD45 es la de defosforilar la tirosina de regulación negativa de c-lck y c-fyn, con lo que estas cinasas se activarían autofosforilándose y fosforilando con toda probabilidad otros substratos próximos (como la cadena ζ del CD3). No obstante, el CD45 podría defosforilar también a la tirosina de c-lck y c-fyn previamente autofosforilada conduciendo a una inhibición de estas cinasas.Aunque estos modelos son hipotéticos, se acumulan continuamente evidencias de que el CD45 pude regular positiva o negativamente los procesos de activación celular. En este último caso es importante destacar que la región citoplasmática del CD45 puede ser fosforilada vía Proteína Cinasa C (PKC) en residuos serina y como se verá a continuación en el tiempo es posterior a los procesos de fosforilación en tirosina descritos anteriormente por lo que es posible que esta fosforilación de CD45 sea necesaria para inducir su actividad fosfatasa de regulación negativa. En la Figura 10.8 se muestra la estructura de una tirosin cinasa p56.PLC-gamma-1 Después del reconocimiento antigénico por parte del TCR esta PLC-gamma-1, se fosforila en tirosina y se activa dentro de los complejos multimoleculares lipídicos de la membrana plasmática donde induce la hidrólisis de su substrato específico, el fosfatidilinositol bifosfato (PIP2), generándose los metabolitos inositol trifosfato (IP3) y diacilglicerol (DAG) (F igura 10.9) . El IP3 se une a un receptor específico (IP3R) localizado en unas estructuras específicas del retículo endoplásmico facilitando la liberación del calcio intracelular de sus compartimentos y aumentando la concentración de estos iones en el espacio libre intracelular. El IP3, posiblemente en conjunción con su metabolito, el IP4, puede regular los canales de calcio de la membrana plasmática permitiendo la entrada de calcio del exterior al interior celular.El calcio intracelular puede estimular la enzima calmodulina, que es una serina/treonina cinasa que puede activar a su vez a la fosfatasa calcineurina. Además de la activación del sistema calmodulina/calcineurina, los niveles altos de calcio intracelular también ayudan a la activación de otras cinasas como son algunas isoenzimas de las proteína cinasas C (PKC) y posiblemente algunas cinasas activadas por mitógenos (MAPKs). El otro metabolito de la hidrólisis del PIP2, el diacilglicerol es el principal responsable de la activación de las enzimas proteína cinasas C.PROTEINA CINASAS C Las proteína cinasas C (PKCs) son una familia de isoenzimas que están ampliamente distribuida en tejidos y órganos de mamíferos. Esta familia de serina/treonina proteína cinasas está constituida por varias subfamilias que engloban distintas isoformas. Hasta el momento, se conocen 11 isoenzimas de PKC diferentes, clasificadas según su

estructura y necesidad de cofactores para su activación. Aunque todas las isoformas de PKC se activan mediante fosfolípidos, estas isoenzimas en particular se diferencian marcadamente en su sensibilidad hacia el calcio. Teniendo en cuenta este factor, podemos clasificar estos 11 genes de PKC de mamíferos conocidos hasta ahora en las siguientes subfamilias:1. PKC convencionales (cPKC): su activación es dependiente de Ca++ y diacilglicerol (DAG). Esta subfamilia
engloba las siguientes isoformas: alfa, beta (1 y 2) y gamma.
2. PKC novel (nPKC): su activación es dependiente de diacilglicerol e independiente de Ca++. Esta subfamilia engloba distintas isoformas: delta,epsilon, etc.
3. PKC atípica (aPKC): pertenecen estructuralmente a esta familia de enzimas, pero no se activan mediante ésteres de forbol o diacilglicerol. Esta subfamilia engloba varias isoformas.
Las PKCs en condiciones de reposo celular se encuentra localizada en el citosol donde es inactiva, una vez que recibe el estímulo del DAG conjuntamente con iones Ca++ (dependiendo del isotipo enzimático) se transloca a la membrana celular donde en presencia de fosfolípidos (fundamentalmente fosfatidilserina) ejerce su función de cinasa de proteínas en aminoácidos serina y treonina. La implicación de las PKCs en el transcurso de activación de células T ha sido bien establecida desde finales de los años 70. Así, las células T expresan múltiples isotipos de PKC, incluyendo PKC-alfa,-beta1 y otros; sin embargo, el papel de los diferentes isotipos de PKC en la regulación de la señalización celular y la transcripción génica no está aún establecido definitivamente. La activación de linfocitos T implica una compleja cascada de respuestas celulares, que incluye la entrada en el ciclo celular y la liberación de citocinas. La estimulación de células T resulta en la transcripción de varios genes y en la expresión de una determinada variedad de moléculas, incluyendo las citocinas y sus receptores específicos (como es el caso de IL-2 y su receptor). Las PKCs regulan la activación de genes de células T mediante el control de varios factores de transcripción.GAP-RAS La familia de los proto-oncogenes Ras comprende al menos tres genes que codifican otras tantas proteínas denominadas Ha-, Ki- y N-Ras, que juegan un papel crítico en el control de la proliferación celular.Las tirosinas cinasas activadas por la ocupación del TCR no solamente inducen la hidrólisis de fosfolípidos, sino que también activan vías de señalización a través de Ras y mediadas por Lat. Este adaptador fosforilado por ZAP-70 se une a otro adaptador intermediario (Grb-2) que contiene dominios SH2 y SH3. Este último se une a proteínas

específicas fosforiladas en tirosina a través de su dominio SH2 y a una proteína de intercambio de nucleótidos de guanina (Sos) mediante su dominio SH3. La proteína de intercambio actúa entonces sobre la forma inactiva de Ras (ras-GDP) convirtiéndola en su forma activa (Ras-GTP), el cual se une y retiene a c-Raf cerca de la membrana plasmática. Esta acción mediada por Ras, hace que Raf se active y actúe como una cinasa de MAPK (MAPKK) que a su vez activa y fosforila una o más MAPKs, incluyendo a ERK-1 y ERK-2, las cuales tras dicha activación migran al núcleo donde regulan por fosforilación a determinados factores de transcripción involucrados en la proliferación y diferenciación celular. La inactivación de Ras (Ras-GTP) se debe a la acción de la proteína p120GAP o proteína activadora de GTPasa que es la responsable de hidrolizar el GTP unido a Ras y convertirlo en GDP (Ras-GDP) por lo que se la puede considerar como un regulador negativo de Ras. Esta cascada de señalización termina con la fosforilación de determinados factores de transcripción que participan en la activación y funcionalidad de los linfocitos T (Fig. 10.9).FOSFATIDILINOSITOL-3' CINASA (PI3K). Además de la PLCgamma1, otras enzimas presentes en las células T que participa en el metabolismo de fosfolípidos son las denominadas fosfatidilinositol-3' cinasas (PI3Ks), que fosforilan el PIP2 generando cuatro especies de inositoles específicos que son; i) el fosfatidilinositol 3-fosfato; ii) el fosfatidilinositol 3,4-bifosfato; iii) el fosfatidilinositol 3,5-bifosfato y iv) el fosfatidilinositol 3,4,5-trifosfato.. Una de las dianas mejor caracterizadas de la acción de estos lípidos fosforilados es la proteína cinasa B. En respuesta a estímulos externos, la Akt citosólica (inactiva) se transloca a la mebrana plasmática por los estos inositoles fosfatos y se fosforila y activa. Una vez que Akt está activa es capaz de fosforilar y activar a su vez una gran variedad de substratos (BAD, CREB, factores de transcripción de la familia forhead, la cinasa IkB, la procaspasa-9, etc.), explicando el por qué de la importancia de esta cinasa como elemento clave en los procesos de proliferación y diferenciación celular.PROTEINA CINASA ACTIVADA POR MITOGENOS (MAP-CINASAS).En los últimos años se ha identificado y caracterizado parcialmente un sistema de transmisión de señales crucial no solo para la activación de células T sino también para todas las células eucariotas. Este sistema de traducción de señales está regulado por las MAPKs (mitogen activated protein kinases) que de alguna manera actúan como puente entre tirosinas cinasas próximas a la membrana con otras cinasas que fosforilan en aminoácidos serina/treonina una serie de factores de transcripción regulando así su actividad transactivadora. Estas MAPKs engloban a una familia de serina/treonina cinasas, que son activadas cuando a su vez se fosforilan en serina/treonina o tirosina. Al menos tres

subfamilias de MAPKs han sido bien identificadas, i) las ERK1 y 2 (Extracellular Regulated Kinases), 2) la subfamilia de c-Jun cinasas, JNK1, JNK2 y JNK3 (también llamadas SAPK), y 3) la subfamilia p38 (p38, p38b, p38g, y p38d). Las ERKs activadas migran al núcleo donde regulan la transcripción de c-fos, que forma dímeros con c-jun para formar el complejo AP-1, que es fosforilado por las JNK en la subunidad c-jun, regulando su actividad transcripcional. La p38 también participa en la activación de AP-1 y recientemente se ha descrito que en linfocitos T actúa como limitador de la regulación transcripcional mediada por el factor de transcripción NF-AT.Las MAPKs son reguladas a su vez por otras cinasas denominadas MAPKK, y estas a s vez por otro grupo de cinasas que por inercia han sido llamadas MAPKKK (ej, Raf). Estas últimas actuarían como integradores de las señales inducidas por la ocupación de receptores de activación (ej. el TCR), fosforilando a las MAPKK, y estas a su vez fosforilando a las MAPKs en residuos treonina y tirosina.FACTORES DE TRANSCRIPCION. Tras la activación de las células T se transcriben alrededor de 100 genes (conocidos). La activación de esta plétora de genes ocurre de una manera secuencial, de manera que alguno de ellos se transcriben inmediatamente después del reconocimiento antigénico y otros incluso días después. Por este motivo se pueden clasificar de manera didáctica en genes inmediatos (su transcripción ocurre entre diez y treinta minutos después de la activación), tempranos (transcritos entre treinta minutos y dos días) y tardíos (transcripción entre dos días e incluso hasta dos semanas). Entre los primeros tenemos los genes c-fos, c-jun, c-myc, NF-KB/rel, etc., entre los segundos están la mayoría de las interleucinas producidas por células T así como alguno de sus receptores y entre los terceros podemos destacar moléculas como el CTLA-4 y los genes VLA (very late antigen) (F igura 10.9) ..En general, la transcripción de genes inmediatos ocurre en ausencia de síntesis de novo de proteínas, lo cual indica que estos genes son activados por factores de transcripción preexistentes en la célula. Estos factores después de la cascada activación de cinasas y fosfatasas originada por el reconocimiento antigénico son fosforilados o defosforilados y de esta manera activados. En este estado se unen a regiones reguladoras de la transcripción situadas generalmente en los promotores de determinados genes permitiendo su transcripción o a veces incluso su represión.Así, la primera etapa de su respuesta celular culmina con la expresión en el núcleo de proteínas trans-activadoras que regulan la transcripción de una serie de genes involucrados en los procesos de proliferación, diferenciación y adquisición de funciones en los linfocitos T.Una de las funciones más importantes de los linfocitos T es la producción de linfocinas, las cuales, en última instancia,

junto a los procesos de interacción e celulares, van a modular el tipo de respuesta inmune producida. Los mejores ejemplos de regulación genética de linfocinas lo encontramos en la regulación de la IL-2, así como de su receptor (principalmente la cadena alfa). En la parte 5' del gen de la IL-2 se encuentra una región de aproximadamente trescientos pares de bases (entre las bases -319 y -52) que contiene los sitios de unión para factores como, NF-κB, NF-AT, factores octaméricos, AP-1 y además un sitio de unión conocido como CD28RE (CD28 responsive element). Estudios moleculares han demostrado que la acción conjunta de estos factores es necesaria para conseguir una activación completa del gen de la IL-2. La expresión de alguno de estos factores está restringida a determinados tipos celulares, como es el caso de NF-AT, mientras que otros como AP-1 y NF-κB están expresados en una gran variedad de tipos celulares.Factor nuclear de la cadena K de células B (NF-κB/rel). NF-κB (factor nuclear de la cadena Kappa en células B) fue caracterizado por primera vez, en 1986, como un factor específico de células B y que se unía a una secuencia localizada en el promotor de la cadena ligera de las inmunoglobulinas. NF-kB se encuentra fundamentalmente en todos los tipos celulares y está implicado en la activación de multitud de genes en respuesta a inflamación, infección y otras situaciones de stress que requieren una rápida reprogramación de la expresión génica..Este factor de transcripción está formado por una familia de proteínas que presentan una alta homología entre ellas y que está compuesta principalmente por las proteínas p50, p52, p65, RelB, y c-rel. Estas proteínas pueden estar formando distintos complejos entre ellas siendo los mas comunes p50/p50 y p50/p65. Los distintos complejos tienen distintas afinidades por los sitios de unión al DNA y posiblemente tengan diferentes actividades transactivadoras. Esto se puede entender por el hecho de que la región de DNA que se una a NF-kB es GGGRNNYYCC, este decámero palindrómico no es exactamente igual en todos los genes que contienen una región NF-kB y así, estas pequeñas diferencias pueden ser las responsables de las diferentes afinidades de los complejos NF-kB/rel por el DNA.Los complejos de NF-κB se encuentran retenidos en el citoplasma por moléculas llamadas inhibidores de NF-κB o IκB. Dos de las más estudiadas en linfocitos T son IκB-a e IκB-b que en condiciones de reposo están unidas a los dímeros de NF-kB enmascarando así su señal de localización nuclear (NLS), previniendo de esta forma el desplazamiento de NF-kB al núcleo La activación de linfocitos T vía TCR/CD3, IL-1 o TNF entre otros estímulos extracelulares inducen una cascada de cinasas y proteasas que median la degradación de IκB por un proceso combinado de fosforilación, ubiquitinación y proteolisis, como consecuencia del cual se producen la liberación de NF-κB/rel y su translocación al

núcleo (F igura 10.9) .Además de participar en la transcripción de la IL-2 y de su receptor se ha demostrado que NF-κB puede trans-activar también un amplio número de genes en linfocitos T como son la cadena beta del TCR, genes HLA de clase I y clase II, beta-2-microglobulina, moléculas de adhesión como ICAM-1, otras linfocinas como IL-6, IL-8 y el G-CSF, proto-oncogenes como c-myc y también se une a las regiones promotoras (LTR) de virus como el HIV y HTLV-1.La activación de NF-kB representa el paradigma del control de proteínas mediante un proceso de ubiquitinación y degradación en el proteasoma integrado a la cascada de fosforilaciones. Recientemente, ha habido un gran progreso en lo que concierne a la ruta de señales de NF-kB, especialmente las relacionadas con las citocinas proinflamatorias, IL-1 y tumor necrosis factor alfa.Activador de proteína 1 ( AP-1)A diferencia de NF-KB, AP-1 (Activador protein 1) es un factor de transcripción exclusivamente nuclear que se activa por fosforilación mediada por determinadas cinasas que se translocan al núcleo e inducen en este factor una modificación postranslacional que le hace activo.El factor de transcripción AP-1 (Activator Protein 1) está formado por proteínas ubicuas pertenecientes a las familias Jun (c-Jun, v-Jun, JunB y JunD), Fos (c-Fos, FosB,Fra1 y Fra2) o ATF (ATF2 y ATF3) capaces de unirse a una secuencia consenso de ADN denominada TRE (TPA response element, TGACTCA) regulando la transcripción de alto número de genes que incluye genes de citokinas proinflamatorias entre otros. Los miembros de las familias Jun o ATF forman homodímeros o heterodímeros con los miembros de las otras dos familias, pero en el caso de las proteinas Fos, éstas solo forman heterodímeros. La integración de las señales transmitidas por las distintas MAPKs (ERK, p38, JNK) activadas tras la activación del receptor TCR provoca la unión de determinados factores de transcripción (TCF, SRF) a los genes que codifican para Fos y Jun, aumentando su presencia en el núcleo. Posteriormente, Fos y Jun son fosforilados por FRK y JNK respectivamente (cinasas reguladoras de Fos y Jun). De este modo, ambos factores de transcripción activados, dimerizan y se unen a regiones específicas de los promotores de genes como la IL-2 y otros genes que participan en la respuesta inmune e inflamatoria (F igura 10.9) .Factor nuclear de células T activadas ( NF-AT).La familia de proteínas NF-AT (Nuclear Factor of Activated T cells) está constituida al menos por cuatro miembros NF-AT1/p, NF-AT2/c, NF-AT3, y NF-AT4/x, presentando cada uno de ellos, excepto NF-AT3, varias isoformas probablemente derivadas de splicing (corte y empalme) alternativo del mismo gen. Todas las isoformas presentan

dos regiones de secuencia homólogas entre ellas, el dominio de unión al ADN (DBD) y la región homóloga para NF-AT (NHR). El DBD, comprendido aproximadamente entre los aminoácidos 400 y 700, es la zona más conservada entre los miembros de la familia NFAT. La región NHR constituye el dominio principal de transactivación de la proteína y es el sitio de anclaje donde se une la fosfatasa calcineurina, que cuando se activa defosforila múltiples residuos fosforilados de esta zona, controlando así la translocación nuclear de NF-AT. En un principio NF-AT se identificó en células T como un complejo rápidamente inducible que se unía al elemento distal de respuesta a antígeno en el promotor del gen de la IL-2. Su inducción requiere la señalización por calcio y se inhibe con drogas inmunosupresoras como CsA y FK506, que inhiben la actividad fosfatasa de la calcineurina. El complejo NF-AT activo unido al ADN está formado por un componente citosólico presente en células T y por un componente nuclear ubicuo. El componente citosólico está constituido por los miembros de la familia NF-AT mientras que el componente nuclear está formado por miembros de la familia Fos y Jun que constituyen el factor de transcripción AP-1. En los últimos años se ha identificado la existencia de miembros de la familia NF-AT en otras células del sistema inmune distintas a los linfocitos T y donde también regulan la expresión de numerosos genes de citocinas (IL-4, TNFalfa y GM-CSF) y de receptores de superficie (FasL, CD40L). La expresión de NF-AT3 y NF-AT4 también ha sido descrita en células fuera del sistema inmune, lo que explicaría en parte los efectos secundarios de la CsA fuera del sistema inmune. Como se ha comentado anteriormente, la activación fisiológica del TCR da lugar a la movilización de Ca++ y con ello la activación de la fosfatasa calcineurina que defosforila a NFAT, altamente fosforilado en células T en reposo. La translocación al núcleo, el aumento de afinidad para unirse al ADN y la inducción de la actividad transcripcional de NF-AT están regulados por esta defosforilación. La asociación física entre la calcineurina y NFAT sigue incluso en el núcleo donde la calcineurina sigue defosforilando al factor mientras los niveles de calcio intracelulares sigan altos. En gran parte las secuencias de reconocimiento para NF-AT necesita de la cooperación de proteínas AP-1 para transactivar dichos genes. Además, esta interacción entre AP-1 y NFAT con el ADN, confiere al complejo NFAT/AP1:ADN una estabilidad 20 veces superior a la que presentan los complejos NFAT:ADN. Por tanto las rutas de señalización que convergen en la activación de AP-1 van a afectar la actividad transcripcional mediada por los complejos NFAT/AP-1 INMUNOPATOLOGIA

Se han descrito alteraciones de muchas de la cinasas que intervienen en la activación de los linfocitos T. Así, se ha descrito el déficit de Zap-70 en individuos que tenían en común valores muy bajos o ausentes de linfocitos T CD8+ en sangre periférica. Los linfocitos de los pacientes no proliferan en respuesta a lectinas, a anticuerpos monoclonales anti-CD3, a antígenos o a células alogénicas. Los análisis de laboratorio revelaron la ausencia de Zap 70 en los linfocitos T de los pacientes. BIBLIOGRAFIA
1. Isakov,N. and Altman,A.: Protein kinase C(theta) in T cell activation. Annu.Rev.Immunol 2002, 20:761-794.2. Lewis,R.S.: Calcium signaling mechanisms in T lymphocytes. Annu. Rev.Immunol. 2001, 19:497-521.3. Myung,P.S., Boerthe,N.J., and Koretzky,G.A.: Adapter proteins in lymphocyte antigen-receptor signaling.
Curr. Opin. Immunol. 2000, 12:256-266.4. Nakanishi,K.: Innate and acquired activation pathways in T cells. Nat.Immunol.2001, 2:140-142.5. Nemec,M.: Web alert. Lymphocyte activation and effector functions. Curr.Opin.Immunol. 2001, 265.,
13:2656. Samelson,L.E.: Signal transduction mediated by the T cell antigen receptor: The Role of Adapter
Proteins. Annu.Rev.Immunol 2002, 20:371-394.7. Schatz,D.G. and Malissen,B.: Lymphocyte development. Curr. Opin. Immunol. 2002, 14:183-185.8. Quintana A, Griesemer D, Schwarz EC, Hoth M.: Calcium-dependent activation of T-lymphocytes. Pflugers
2005, Arch. 450: 1-12.9. Weil R, Israel A. T-cell-receptor- and B-cell-receptor-mediated activation of NF-kappaB in lymphocytes. Curr
Opin Immunol. 2004, 16: 374-81.10. Dahlke MH, Larsen SR, Rasko JE, Schlitt HJ. The biology of CD45 and its use as a therapeutic target. Leuk
Lymphoma. 2004, 45: 229-36.
NTRODUCCIONLos linfocitos B son células especializadas que poseen receptores con distribución clonal que tras interaccionar con su ligando específico (antígeno) secretan inmunoglobulinas (Ig) denominadas ahora anticuerpos (Ac). En su biografía hay que distinguir dos fases:

1. Ddesarrollo (linfopoyesis ontogénica) a partir de progenitores linfoides derivados de la célula hematopoyética primordial (HSC), un proceso independiente de estímulo antigénico y durante el cual se reordenan los genes de las cadenas pesadas y ligeras de inmunoglobulinas lo que permite la expresión en membrana de la inmunoglobulina de membrana (mIg conocida también como del receptor de antígeno del linfocito B (BCR),
2. Procesos que experimentan los linfocitos B maduros tras la unión NO covalente del antígeno (Ag) con la mIg, cambios que conducen a su expansión por proliferación celular y que culminan, por un lado, con la generación de linfocitos B memoria, y por otro, con su maduración hasta célula secretora de anticuerpos (ASC), cuyo estadío terminal corresponde a la morfología de célula plasmática, una célula de vida media corta.
Los linfocitos B memoria además de haber perdido la mIgD (al menos la mayoría de ellos), en virtud del mecanismo de recombinación de los genes de la parte constante (genes C) de las Ig, han cambiado la región constante de su mIg, de forma que en lugar de expresar mIgM, expresan mIgG o mIgA o mIgE o combinaciones de mIgM/mIgG o mIgM/mIgA o incluso mIgM/mIgG/mIgA. Esas mIg siguen expresando el mismo tipo de cadenas ligeras y las mismas regiones VH y VL, aunque levemente modificadas por la aparición de cambios puntuales (hasta diez) en ciertos aminoácidos de las regiones determinantes de la complementariedad, lo que in vivo causan una mayor afinidad del anticuerpo por el Ag. Esos cambios se deben al fenómeno de hipermutación somática de los genes que codifican las regiones VH y/o VL (véase Estructura y genética de las Ig). Los linfocitos B memoria son los precursores inmediatos de las ASC productoras de IgG o IgA o IgE de la respuesta secundaria, y se generan en el centro germinal (vide infra, Respuesta de anticuerpos). Aparte de las diferencias de las mIg, no hay ningún marcador conocido que permita distinguir de forma inequívoca, células B memoria de los linfocitos B primarios (Figura 11.1). REPERTORIO DE ESPECIFICIDADES DEL ANTICUERPO El hecho de que los genes V de las Ig se distribuyen clonalmente, es decir, que cada linfocito B exprese una única región VH y una única región VL y por tanto una única especificidad antigénica distinta de la expresada por los otros linfocitos B, constituye el punto esencial de la teoría de la selección clonal, según la cual el Ag exógeno se une (selecciona) a los linfocitos B cuyas Ig de membrana sean específicas (complementarias) para él. El repertorio o catálogo de especificidades anticuerpo distribuidas entre los linfocitos B recientemente formados y que no han tenido contacto

todavía con el Ag exógeno, se denomina repertorio primario o preinmune. Los segmentos de genes VH y VL expresados por las células B primarias, tal como se veía en el capítulo 5, se hallan en configuración germinal (no han experimentado hipermutaciones somáticas, como ocurre tras la respuesta al Ag) y su repertorio surge de los mecanismos recombinatorios de los distintos segmentos génicos VH DH y JH (cadena pesada) y VL y JL (cadena ligera) usados, así como del ensamblamiento de una region VH con una región VL para formar una zona común de unión al Ag. Esas posibilidades combinatorias pueden determinar un repertorio potencial que parece tender al infinito, calculándose que, en el ratón, pueda ser de 108 109. Ello garantiza que cualquier Ag exógeno de los múltiples (potencialmente millones) presentes de forma natural o artificialmente creados por el hombre, que entre en el organismo pueda tener oportunidad de encontrar (seleccionar), aunque sea en muy bajas proporciones, linfocitos B que lo reconozcan. Sin embargo, por estudios de frecuencia de células B específicas contra antígenos definidos (hapteno-portador) se infiere que el repertorio realmente utilizado parece ser mucho menor (106-107).El proceso de maduración de los linfocitos B en la médula es complejo y en él intervienen varias citocinas (Figura 11.2 ).RECEPTOR DE CELULAS B (BCR).Las Ig de membrana de los linfocitos B maduros constituye parte del receptor de Ag (BCR). Las cadenas pesadas de las mIg difieren de las cadenas pesadas de las Ig secretadas en una pequeña parte del extremo carboxi-terminal. El hecho de que las Ig se expresen en la membrana (linfocitos B primarios o vírgenes) o pasen a secretarse tras el contacto con el antígeno, se debe a un mecanismo de empalme diferencial de los exones M1 y M2 de los genes CH presentes en el RNA.La región citoplásmica de la mIgM y mIgD (humanas) sólo tiene 3 aa, (lisina-valina-lisina) mientras que la de las otras mIg es algo mayor (25 aa adicionales para la mIgG e mIgE). Hace unos años quedó claro que el ligamiento cruzado de las mIg (puenteo o agregación) mediante anticuerpos anti-Ig (que vienen a representar la acción del Ag) transducía señales activadoras. Sin embargo, dada la escasa parte citoplásmica de las mIg se sospechaba que no eran las Ig por si mismas las que transducían esas señales a la maquinaria intracitoplásmica generadora de segundos mensajeros, sino que ello podía ser responsabilidad de moléculas asociadas a las mIg, de forma análoga a como ocurre con las moléculas CD3 asociadas al receptor antigénico de las células T (TCR). Actualmente está plenamente establecido que las mIg se hallan asociadas de forma no covalente a un complejo de dos cadenas polipeptídicas unidas entre sí por enlaces disulfuro, llamadas Ig-alfa e Ig-beta, que están codificadas por los genes llamados mb-1 y B29 respectivamenteLa arquitectura del receptor, esto es, número de heterodímeros y orden de las cadenas dentro del heterodímero que

estan en contacto con las cadenas pesadas de la mIg no se conoce, pero el modelo aceptado actualmente asume la configuración que se esquematiza en la Figura 11.3, en que dos heterodímeros estarían en contacto con cada una de las dos cadenas pesadas de la mIg.La parte citoplasmática de las cadenas Ig-a e Ig-b carecen de dominios catalíticos, pero poseen residuos tirosina que son fosforilados por proteín-tirosín-cinasas. El segmento intracitoplasmático del receptor antigénico de célula B (BCR) está asociado de forma no covalente a proteín-tirosín-cinasas (PTK) que catalizan la forsorilación de residuos de tirosina en varios substratos intracelulares, incluidas ellas mismas, inmediatamente después de que se produzca el ligamiento cruzado de las mIg. Dichos procesos de fosforilación se cree que son de importancia capital en la transducción de señales activadoras al interior de la célula, trás la unión del Ag a las mIg. Entre esas PTK se hallan lyn, fyn, blk (y posiblemente otras), pertenecientes a la familia de src-PTC que contactan con la membrana (ver capítulo dedicado a tansmisión de señales en linfocitos). También se halla asociado una PTK no perteneciente a esta familia, denominada syk, que al revés de las del tipo src-PTK es completamente citoplasmática, sin conexión con la membrana y de enorme semjanza a la cinasa ZAP-70 presente en células T. Como se indica más adelante, el BCR se halla funcionalmente asociado al complejo no covalente que forman las moléculas CD21 y CD19.RECEPTOR SUBRROGADO DE LAS CELULAS PRE-B.Las cadenas m libres, es decir no unidas a cadenas ligeras, aunque estén codificadas con los exones apropiados para expresarse en la membrana, no pueden hacerlo. Para ello, además de su ensamblamiento a las cadenas ligeras, se requiere la expresión del heterodímero Ig-alfa e Ig-beta. Las cadenas m producidas por las células pre-B tardías (cuando todavía no se han reordenado los genes V de las cadenas ligeras) quedan retenidas en el retículo endoplásmico unidas a la proteína copuladora de las Ig (BiP) una molécula carabina (que es idéntica a la proteína grp78), donde se degradan. Recientemente se ha visto que una pequeña parte de las cadenas m de las células pre-B no quedan retenidas en el citoplasma sino que son exportadas a la membrana. Ello se consigue gracias a su ensamblaje con una pseudo cadena ligera (y-LC) que subroga la función de las cadenas ligeras auténticas, mientras éstas no se reordenan y expresan.Hay evidencias de que la mIgM subrogada (pre-BCR) de las células pre-B transduce señales que ordenan el cese de más reordenamientos de los genes de las cadenas pesadas, fenómeno subyacente a la exclusión alélica que caracteriza la expresion de los genes de las Ig (véase genes de las Ig) además de favorecer la supervivencia celular mientras se reordenan los genes de las cadenas ligeras.ACTIVACION Y DIFERENCIACION DE LINFOCITOS B.

Teoría de la selección clonal.
Un hito fundamental en el conocimiento de la función de los linfocitos B fue la demostración de que las células B que unen un antígeno determinado son las responsables de la secreción de anticuerpos contra ese antígeno. La producción de anticuerpos solubles requiere la inyección del antígeno (inmunización) al animal en una solución que induce inflamación (adyudante). Se supuso que la interacción física del antígeno con alguna célula del organismo induciría su activación y posterior diferenciación a célula secretora de inmunoglobulinas. Para la demostración de esta teoría se realizaron una serie de experimentos en los que se adicionó un antígeno marcado radioctivamente a un cultivo de célula de bazo (órgano que contiene un abundante número de células B). Aquellos linfocitos B que unían el antígeno morían por irradiación (Figura 11.4). Las células supervivientes (la inmensa mayoría porque sólo 1 de cada 50.000 células unían el antígeno) se transferían a un ratón irradiado letalmente. Sin embargo, la inmunización de ese ratón con el mismo antígeno no despertaba respuesta de anticuerpos específicos, cosa que sí ocurría cuando el antígeno utilizado en la inmunización no estaba marcado radioactivamente. Estos experimentos sólo podían ser interpretados según la teoría denominada de selección clonal. De acuerdo con esta teoría, los linfocitos B tienen receptores distribuidos clonalmente (inmunoglobulinas de membrana responsables de la unión al antígeno) y por tanto, presentan un potencial de estimulación antigénica restringido. Tras el contacto con el antígeno, los linfocitos B se activan y diferencian a células secretoras de inmunoglobulinas, las cuales tienen una especificidad casi idéntica, a la expresada en la membrana de las células B que han unido el antígeno (con mutaciones puntuales en los segmentos VH y VL.Las células B inmaduras que unen antígenos propios son eliminadas (delección clonal) o son incapaces de diferenciarse a células secretoras de inmunoglobulina (anergia). Efectivamente, el desarrollo del sistema inmune necesita compaginar dos fenómenos casi contradictorios; a) generar una enorme diversidad de receptores que reconozcan antígeno y b) seleccionar de todas estas especificidades generadas al azar las no dañinas para el organismo. De no ser así, los autoanticuerpos generados producirían fenómenos inflamatorios destructivos para órganos y tejidos.Las células B inmaduras (aquellas células B que acaban de reordenar los genes de las cadenas ligeras) que interaccionen con antígenos propios multivalentes expresados en alta cantidad en la membrana celular (p.e. moléculas MHC), mueren por un proceso denominado apoptosis, en el que se produce la fragmentación de DNA y la eliminación de fragmentos celulares por células fagocíticas sin liberación de enzimas citoplasmáticas pro-inflamatorias al entorno. De hecho, algunas células B autorreactivas vuelven a intentar reordenar la cadena ligera (edición del receptor) con el fin de

no reaccionar contra elementos propios y poder sobrevivir. Cuando el antígeno propio reconocido por las células B inmaduras es soluble, el linfocito B autorreactivo no muere, pero tampoco se diferencia a célula secretora de inmunoglobulinas. Esta peculiar forma de respuesta se denomina anergia funcional, y trae como consecuencia la modificación de la recirculación tisular de estas células y el acortamiento de su vida media. Cooperación T:B. Teoría de las dos señales.
Primera señal.
En los fenómenos inducidos por el Ag en las células B tras su unión a las Igm, es clásico distinguir tres acontecimientos secuenciales: activación (entrada en la fase G1 del ciclo celular), proliferación (síntesis de DNA y división celular) y maduración y diferenciación hacia ASC. Estos acontecimientos se inician con la unión del Ag a las mIg del BCR. Aunque esa división pueda parecer artificiosa por cuanto fisiologicamente esos fenómenos son un continuum, es útil e importante por cuanto se trata de acontecimientos con un control y requerimentos distintos. Se demostró que la unión no covalente entre el antígeno y la inmunoglobulina de membrana sólo se traducía señales al interior de la célula cuando al menos dos moléculas de mIg se pongan en íntimo contacto (puenteo del BCR). Ello se puede lograr de dos formas, bien porque el antígeno tenga estructuras (epítopos) repetidas y que cada una de ellas interaccione con una molécula de mIg, o bien porque el antígeno sea captado por una célula que lo fije a su membrana facilitando el puenteo de mIg. Dado que el número de linfocitos B con mIg específicas para un determinado Ag es muy bajo, el estudio in vitro de la activación inducida por el Ag se ha modelizado usando anticuerpos anti-Ig, que sirven a modo de panantígeno capaz de unirse a las mIg de todos los linfocitos B, con independencia de la especificidad anticuerpo (activación policlonal). Durante la mitad de los 80 quedó claro que el ligamiento cruzado o puenteo de las mIg por anticuerpos anti-Ig inducían a las células B a entrar en la fase G1 del ciclo célular (activación) que se caracteriza por aumento del tamaño celular y aspecto blástico, hiperexpresión de moléculas HLA de clase II, expresión de antígenos de activación (receptores de IL-2R y de otras citocinas y otros antígenos de activación), formación de agregados celulares mediados por moléculas de adhesión (principalmente a través de la integrina leucocitaria LFA-1 (CD11a/CD18) y su unión a ICAM-1 (CD54), ICAM-2 e ICAM-3 (CDw50) y síntesis de RNA. Esto se puede observar durante las primeras 24-48 hr. del cultivo. Los mecanismos de transducción de señales desde la membrana al citoplasma y luego al núcleo, donde se activará la transcripción de genes implicados en la entrada de la célula en el ciclo celular, son comunes a otros tipos celulares tras interacciones receptor-ligando, y son muy similares a los procesos que se desencadenan tras la interacción del receptor para el

antígeno (TCR) de los linfocitos T con el complejo péptido- molécula MHC. Sin embargo, estos cambios incluyen como mínimo : activación de tirosin-cinasas asociadas al BCR, que catalizan la fosforilación de varios substratos intracelulares, incluidas ellas mismas, así como la fosfolipasa C-gamma (PLC-gamma), CD19, y las cadenas Ig-alfa e Ig-beta. La fosforilización de la PLC se cree que causa su activación con lo que luego cataliza la hidrólisis de fosfoinositoles, generándose inositoltrifosfato (IP3) y diacilglicerol (DAG) que causan , respectivamente, aumento del calcio libre intracelular (primero por descaraga de los almacenes internos, despues por entrada de calcio extracelular) y activación de la protein-cinasa C (PKC). La importancia de la activación de la PKC para la activación de las células B, fué corroborado por el hecho de que los esteres de forbol, que causan la activación de la PKC y su translocación a la membrana celular, en conjunción con ionóforos de calcio, que causan entrada de calcio extracelular, actúan de modo sinérgico causando los mismo fenómenos activatorios que los anticuerpos anti-Ig. De hecho la combinación de esos agentes farmacológicos, constituye el activador policlonal más potente de células B.Hoy en día se acepta que por muy favorable que sea la estimulación de linfocitos B vía mIg, siempre que se estudien células mIgM+/mIgD+ verdaderamente quiescentes y altamente purificadas, la activación B no suele progresar hacia síntesis de DNA, ni muchísimo menos madura hacia ASC. Ello llevo a hipotetizar que las células B necesitaban dos señales para su diferenciación terminal, una proveniente del puenteo de la Ig de membrana y otra segunda señal proveniente de alguna célula accesoria. Segunda señal. Papel de los linfocitos T
Los experimentos que involucraban a las células T en la diferenciación de células B tienen su base en experimentos muy antiguos de cooperación entre células provenientes de médula ósea (linfocitos B) y timo (linfocitos T). Estos experimentos se interpretaron bajo la hipótesis de que las células B eran capaces de producir anticuerpos pero para ello requerían el auxilio de células T. Veamos la naturaleza de esta segunda señal:
1. Factores solubles. Los estudios de este fenómeno se basaron en experimetos que demostraron que los linfocitos T eran capaces de producir factores solubles tras su estimulación con antígenos o mitógenos, y que algunos de estos factores solubles estaban involucradas en procesos de proliferación. Así, se probó el efecto de sobrenadantes de células T activadas en la proliferación y diferenciación de células B. Se demostró que la adición de estos factores solubles (citocinas) a células B estimuladas con anti-IgM eran capaces de inducir proliferación de células B pero no su diferenciación (Figura 11.5). Sin embargo, se obtuvieron datos

aparentemente contradictorios con este postulado al lograrse “in vitro” la diferenciación de células B de tamaño superior al normal y de una densidad baja en presencia únicamente de factores solubles. Datos posteriores evidenciaron que estas células B probablemente habían sido activadas in vivo, probablemente gracias a la colaboración T, y por ello su diferenciación final aparentemente sólo requería factores solubles (vide infra).
2. Moléculas de membrana. Se ha demostrado que tanto los linfocitos B como las células T que han reconocido antígeno expresan en su membrana transitoriamente moléculas de activación, con ligandos recíprocos. Así, las células B expresan las moléculas de activación CD80 y CD86 que interaccionan con CD28 presente en linfocitos T mientras que la molécula de activación de linfocitos T CD40-L se une a CD40 presente en linfocitos B.C) Cooperación entre factores solubles y moléculas de activación. Diversos abordajes experimentales han demostrado que las moléculas de activación presentes en linfocitos T y B activados con ligandos recíprocos unidas a la secreción de interleucinas por linfocitos T son las señales que hacen diferenciarse a linfocitos B que han contactado con el antígeno y por tanto constituyen conjuntamente la segunda señal.(Figura 11.5).
Cooperación linfocitos T y B.
Veremos separadamente los procesos relacionados con la activación de linfocitos T y después de linfocitos B.
Activación de linfocitos T.
Al igual que los linfocitos B, las células T necesitan el puenteo de su receptor antigénico para la modificación de su fisiología y con ello la ganancia de ciertas funciones que antes no tenía, tales como secreción de factores solubles, expresión en membrana de moléculas de activación, etc. El receptor de linfocitos T no reconoce, tal y como lo hacen los linfocitos B, una enorme variedad de estructuras moleculares (incluyendo hidratos de carbono) sino que está sesgado para el reconocimiento de moléculas del complejo principal de histocompatibilidad (MHC) debido a un proceso de selección que tiene lugar en el timo. Las moléculas codificadas en el MHC son capaces de alojar péptidos en un hendidura que aparece en su estructura cuaternaria. El receptor de linfocito T sólo es capaz de unirse a complejos péptido-MHC, interaccionando los aminoácidos de las cadenas que forman el receptor de linfocito T tanto con aminoácidos del péptido como de la molécula MHC en la que éste se encuentra alojado. Estos péptidos se generan por la proteolisis de proteínas generadas en el interior de la célula (por ejemplo proteínas virales) o de aquellas captadas del

medio externo tras su endocitosis o pinocitosis (proteínas bacterianas). Este proceso se denomina presentación antigénica.También la activación de las células T requiere otra segunda señal no del todo aclarada pero que probablemente sea debida a la interacción de proteínas de membrana de la célula presentadora con otras proteínas de membrana del linfocito T. Es importante resaltar que sólo algunas células del organismo son capaces de facilitar a las células T esta segunda señal, a las que se denominan células accesorias. Si el linfocito T reconoce un péptido en una célula sin capacidad accesoria, el linfocito T no sólo no se activa, sino que se hace refractario a activación, entrando en un proceso denominado anergía. Las células que clásicamente se les ha considerado células accesorias (monocitos, macrófagos y células dentríticas) captan el antígeno bien por pinocitosis o por endocitosis a través de receptores para el fragmento Fc de Ig (RFc), receptores de factores de complemento (RC) o receptores de manosa.Célula B como célula presentadora de antígenos T dependientes.
En 1985 A. Lanzavecchia demostró que la inmunoglobulina de superficie de células B era capaz de captar y de concentrar antígenos solubles de naturaleza proteica (antígenos T dependientes) permitiendo una presentación antigénica a células T extremadamente eficaz. Esta nueva función de linfocitos B podría ser la base de respuestas de anticuerpos específicas a bajas concentraciones de antígeno, y, al mismo tiempo, explicaría la especificidad de la respuesta inmune. Los linfocitos B que interaccionaran a través de su Igm con un antígeno denominado por ejemplo X, lo procesarían y presentarían unidos a MHC péptidos del mismo antígeno X (péptidos-X). Los linfocitos T con especificidad anti-(peptidos-X) que han interaccionado previamente con el antígeno en células accesorias clásicas, reconocerían el complejo MHC-péptido en la membrana de la célula B, transmitiendo las segundas señales necesarias para la diferenciación de células B (factores solubles más interacción membrana-membrana) (Figura 11.6).Es importante destacar que las partes del antígeno X reconocidas por linfocitos T y B pueden ser muy distintas. Las células B pueden interaccionar con los hidratos de carbono de la glicoproteina X, mientras que los linfocitos T anti-X sólo reconocen péptidos de esta proteína X. Un ejemplo clásico de este tipo de reconocimiento es la respuesta a haptenos que no contengan aminoácidos. Los haptenos son estructuras moleculares de pequeño tamaño que pueden ser reconocidas por ciertas inmunoglobulinas de membrana, pero que paradójicamente son incapaces de inducir la diferenciación de células B tras su inyección “in vivo” por no recibir la cooperación de linfocitos T. Por ejemplo, haptenos que no contengan aminoácidos (poliazúcares) no pueden presentar ningún péptido presente en su estructura a linfocitos

T, por lo que no se generarían las segundas señales necesarias para la diferenciación de linfocitos B hapteno específicos (los que han unido hapteno a través de su BCR). Lógicamente, la inmunización de una nueva estructura molecular en la que el hapteno se uniera convalentemente a proteínas no presentes en el animal (no propias) sí despiertan una respuesta de anticuerpos “in vivo”. Ello se debe a que las células B que unen el hapteno, endocitan el complejo hapteno-proteina (denominada transportadora o carrier)., degradan enzimáticamente la porción proteica generando péptidos que se unen a MHC. Esta estructura peptido-MHC sería reconocida por algunos linfocitos T CD4, que se activarían y generarían segundas señales que permitirían la diferenciación terminal de estas células B que secretarían inmunoglobulinas anti-haptenoDado que los linfocitos T han sufrido un proceso de selección en timo por el que se han seleccionado aquellos con una cierta afinidad por moléculas MHC propias y considerando que previamente han reconocido el antígeno (más exactamente un péptido de él) en el contexto de moléculas MHC propias presentes en la célula accesoria presentadora de antígeno, es lógico que las células T sólo cooperan con células B que hayan unido el antígeno y lo hayan presentado en moléculas MHC idénticas a las presentes en células dentríticas, que en coondiciones fisiológicas son también las presentes en células T. Como las moléculas MHC son polimórficas en poblaciones, las células B, T y dentríticas deben expresar el mismo alelo MHC al que se une el péptido para cooperar entre sí, fenómeno por ello denominado “restricción alélica HLA”. Otras vias de activación de células B.
Entre estas vías destacan las son antígenos T independientes de aquellas que son antígeno T dependientes, según el grado de necesidad de que participen estos linfocitos en la respuesta inmune.Antígenos T independientes.
Algunos antígenos son capaces de despertar una respuesta de anticuerpos en ausencia de células T. Este tipo de antígenos se ha dividido en dos grupos, los denominados antígenos T independientes 1 (TI-1) o 2 (TI-2). Los antígenos TI-1 son antígenos de la pared bacteriana que inducen una diferenciación policlonal de células B murinas independiente de la especificidad de su receptor clonotípico, ya que este no interviene en el reconocimiento. El ejemplo clásico en el modelo experimental murino es la respuesta a LPS (Figura 11. 7). Por el contrario, los antígenos TI-2 son estructuras repetidás, normalmente hidratos de carbono, que son reconocidos por el receptor B. Las características moleculares de los Ag TI-2 hacen que se produzca un puenteo de varias moléculas de

Igs (un número crítico parece ser de 12-16). Este puenteo masivo local favorece la activación de linfocitos B, aún en la ausencia de una interacción T:B membrana-membrana. Cómo ya hemos desarrollado, los hidratos de carbono no puede activar células T al no contener aminoácidos en su estructura molecular. Así, el puenteo masivo de Igm por antígenos TI-2 provoca un estado de activación en el linfocito B, en el cual los contactos membrana-membrana con linfocitos T no son necesarios. Sin embargo parece que factores solubles producidos por células T o no T (mastocitos) sí juegan un cierto papel en este tipo de respuesta.Tanto los antígenos TI-1 como TI-2 se encuentran sobre todo en bacterias, sugiriendo que la respuesta antibacteriana pueda tener un componente T independiente. Este parece ser el caso, ya que las inmunodeficiencias T genéticas o adquiridas no suelen asociarse a un aumento exagerado de infecciones bacterianas. De hecho, recientemente se ha descrito la activación policlonal de linfocitos B tras su interacción con DNA bacteriano en un proceso en el que no interviene el BCR, por lo que este DNA podría considerarse un antígeno TI-1.Es de destacar que en general, los epitopos reconocidos por las células B no corresponden a los reconocidos por los linfocitos T (Figura 11. 8). Una vez que las células B se activan adecuadamente, éstas se transforman en células plasmáticas (Figura 11. 9) o en células memoria que por su situación de preactivadas responden con gran eficacia en estímulos posteriores.BIBLIOGRAFIA
1. Weil R, Israel A. T-cell-receptor- and B-cell-receptor-mediated activation of NF-kappaB in lymphocytes. Curr Opin Immunol. 2004, 16: 374-81.2. Villiers MB, Perrin-Cocon L, Marche PN, Villiers CL. Complement receptors and B lymphocytes. Crit Rev Immunol. 2004, 24: 465-78.3. Jumaa H, Hendriks RW, Reth M. B cell signaling and tumorigenesis. Annu Rev Immunol. 2005, 23: 415-45.4. Viau M, Zouali M. B-lymphocytes, innate immunity, and autoimmunity. Clin Immunol. 2005, 114: 17-26.5. Edry E, Melamed D. Receptor editing in positive and negative selection of B lymphopoiesis. J Immunol. 2004, 173: 4265-71.6. Diamant E, Melamed D. Class switch recombination in B lymphopoiesis: a potential pathway for B cell autoimmunity. Autoimmun Rev. 2004, 3: 464-9.















![Activación linfocitos t[1]](https://static.fdocuments.ec/doc/165x107/557d26f3d8b42a90748b4782/activacion-linfocitos-t1.jpg)